Dessine moi une molécule
Saint-Ex aurait été bien embarrassé…
Avec la commercialisation récente en France de l’énantiomère dextrogyre de la kétamine, la S(+)kétamine ou eskétamine, qui s’appelle désormais Eskésia, je me suis replongé dans la lecture (une centaine d’articles) pour préparer une conférence sur le sujet au congrès annuel de la société française d’anesthésie-réanimation, docteur es-kétamine oblige.
La kétamine fut synthétisée il y a 60 ans, en 1962, par Calvin Stevens, aux laboratoires Parke-Devis à détroit dans le Michigan. Les premiers essais chez l’homme furent menés par Edwards F. Domino au début des années 60, chez des prisonniers (on se croirait dans « les thanathonautes« ). Une partie des travaux principaux fut publiée par Paul F. White au début des années 80, et dès cette époque, il apparut que les deux isomères optiquement actifs de la kétamine possédaient des propriétés différentes.
Effectivement, la kétamine ou 2-orthochlorophényl-2-méthylamino-cyclohexanone (ceux qui ont fait un peu de chimie comprendront, les autres me pardonneront), possède un carbone 2 dit asymétrique, où se branchent les différents radicaux. Deux isomères sont possibles, comme en miroir l’un de l’autre, et bien sûr, en raison de relations type « clé-serrure » avec leur récepteur (le fameux récepteur NMDA), un seul d’entre eux, l’eskétamine, est réellement actif. Les isomères dévient la lumière dans des sens opposés, on parle d’énantiomères. L’eskétamine est dextrogyre et notée (+) et la R(-)kétamine ou arkétamine, lévogyre, et notée (-).
Toutefois, les appellations S(+) et R(-) peuvent paraitre contradictoires. Il n’en est rien pourtant. Les deux classifications sont indépendantes. J’ai donc eu besoin de comprendre l’intimité de leur structure spatiale, sénestre (S) pour l’eskétamine, et droite (R), pour l’arkétamine. Dans la molécule de kétamine, du fait des forces électroniques, le cycle cyclohexanone adopte une conformation dite « chaise« . L’oxygène se trouve dans le plan du cycle, on dit en position équatoriale. Dans ces conditions, le radical orthochlorophényl est perpendiculaire au cycle, ou en en position axiale, et le radical méthylamino en position équatoriale. Si on numérote les radicaux du carbone 2 par ordre atomique croissant (chlorophényl, puis méthylamino, enfin oxo) ils s’enroulent dans le sens inverse des aiguilles d’une montre pour l’eskétamine, d’où sa structure dénommée sénestre. C’est l’inverse pour l’arkétamine.
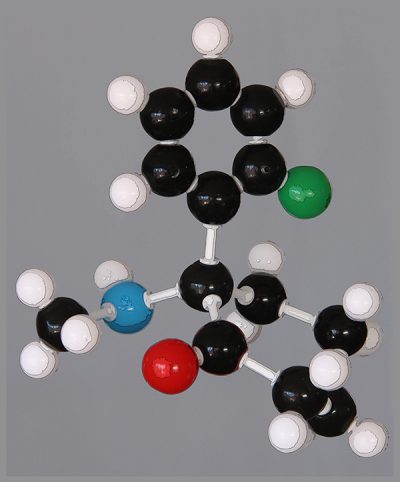
Mais comment appréhender la structure tridimensionnelle d’une molécule complexe ? J’ai d’abord acquis, mais oui, un kit de construction de modèles chimiques, qui m’a permis de prendre la photo qui illustre ce post. J’ai cette passion de la chimie depuis un demi-siècle, quand je me vis offrir à Noël une boite de petit chimiste. Ça s’appelait « chimie 2000 », j’avais dix ans.

J’ai eu vite envie d’aller plus loin et de dessiner moi même dans un logiciel dédié cette kétamine que je fréquente depuis plus de trente ans. Plusieurs solutions existent, je vous en donne quelques unes :
La plus simple : aller sur le site « PubChem« , l’équivalant chimique de PubMed, l’immense base de données scientifique qui est la bibliothèque d’Alexandrie moderne. On y trouve la molécule en 3D, pondue toute fraiche, il n’y a qu’à la manipuler à la souris sous tous les angles. On a le choix du type de représentation, atomes, bâtons, enveloppes électroniques. PubChem répertorie une quantité inépuisable de molécules complexes et comporte même un outil de conception (Draw Structure, sur sa page d’accueil).
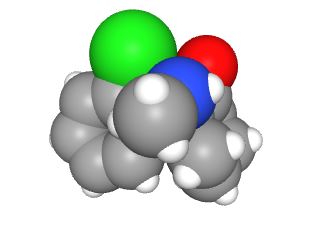
Bon, c’est un peu facile. Moins évident, MolView, une application en ligne, permet de visualiser dans l’espace une molécule qu’on dessine en 2D grâce à des outils très intuitifs. Là encore, choix du type de représentation, mais pas facile de gérer les énantiomères.
Enfin, le top, gratuit de surcroit, c’est… Avogadro. On y construit la molécule directement en 3D (de la vraie Conception Assistée par Ordinateur), atome par atome, ou plus facilement en insérant un radical de la bibliothèque, avec la possibilité d’optimiser les angles des liaisons chimiques de diverses manières, y compris en torturant la molécule avec l’outil auto-optimisation. Ça donne l’impression de triturer un modèle en caoutchouc. Le passage d’un énantiomère à l’autre est simplissime (invert chirality) ! Toutes les représentations sont possibles, on peut animer la molécule et l’usage est intuitif, moyennant la consultation de tutoriels : simple, un peu plus complet, voire exhaustif, mais Avogadro dispense aussi son manuel en ligne. Cerise sur le gâteau, Avogadro importe les formats de sauvegarde (sdf) de PubChem ! Si je l’avais su, j’aurais gagné du temps. Je vous fais ce petit cadeau.
Amusez-vous bien.
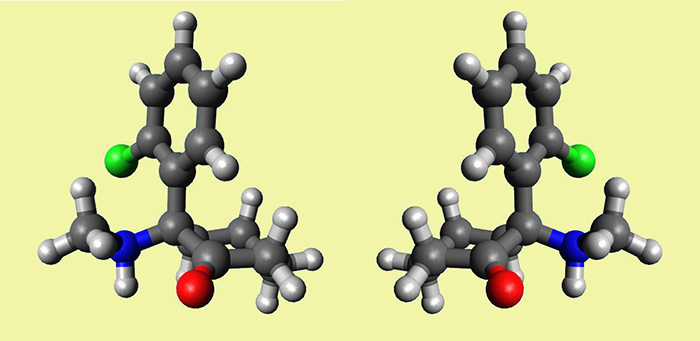
et en bonus une petite vidéo sur mon espace FlickR, capturée dans Avogadro et éditée en ligne, mais c’est encore une autre histoire.
